En mi práctica clínica, es muy común que llegue una persona con los resultados de una analítica y me diga: «Lo tengo todo bien, bueno… excepto el colesterol». Y luego, cuando reviso los resultados, se sorprenden cuando les digo: «Bueno… en realidad, hay muchas cosas que corregir, excepto el colesterol, que lo tienes bien». Es decir, tanto las personas como muchos médicos se quedan tranquilos cuando un biomarcador en la hoja de resultados de sus analíticas no «lleva un asterisco» o no «sale en negrita», es decir, cuando no está fuera del rango «oficial».
Rangos “oficiales”
Aunque ya he tratado este tema en mis libros anteriores, por la confusión generalizada que existe y por la importancia que tiene, quiero explicar de nuevo por qué yo no hago (mucho) caso a los rangos “oficiales” (los que aparecen en las hojas de los análisis) y manejo otros distintos: los rangos “óptimos”. Dos son las razones principales.
Primero. Los rangos «oficiales» que aparecen en las hojas de los análisis se calculan basándose en una desviación estándar, es decir, se establece un rango arriba y abajo de la media de los valores que tienen las personas “sanas» de una población. Pero este cálculo no siempre es el adecuado. Por ejemplo, si en una población hay un déficit generalizado (como suele ser el caso de la vitamina D) o un exceso generalizado (como puede ocurrir con la glucosa, la insulina, los triglicéridos, la homocisteína, etc.), esos rangos estarán mal establecidos porque se basan en un dato incorrecto.
Segundo. Incluso si el rango «oficial» no está afectado por lo anterior y está bien calculado, que algo esté justo por encima o por debajo de esos umbrales solo significa que no existe un déficit o un exceso, pero eso no es lo mismo que decir que el nivel es «óptimo». Estos rangos oficiales son muy amplios, y que algo esté dentro del rango no significa que esté en su mejor nivel. El organismo no funciona igual cuando simplemente no tiene déficit que cuando un biomarcador está en su «mejor sitio». Además, estos rangos amplios son muy poco sensibles para detectar enfermedades en etapas tempranas, lo que significa que algunos individuos con valores «en el borde» del rango normal podrían estar ya en las primeras etapas de una enfermedad.
La teoría del triaje nutricional
Para entender esto mejor, quiero explicar la teoría del triaje nutricional del bioquímico Bruce Ames, de la Universidad de California. El término «triaje» viene del francés trier, que significa ‘clasificar’, y se usa en medicina, especialmente en urgencias, para priorizar la atención cuando los recursos disponibles son superados por la demanda. Por ejemplo, se atiende primero a un paciente grave antes que a uno leve, pero también antes que a otro muy grave que no tiene posibilidades de sobrevivir. Bruce Ames adaptó este concepto al campo de la nutrición proponiendo que, cuando el organismo no tiene suficiente cantidad de un nutriente para realizar todas sus funciones, prioriza las funciones vitales para la supervivencia inmediata a expensas de las secundarias, que afectan a la salud a largo plazo y a enfermedades relacionadas con el envejecimiento, como el cáncer.
Veamos un par de ejemplos, el de la vitamina K y el de la vitamina D.
La función principal de la vitamina K es mantener una coagulación óptima de la sangre, lo cual, en caso de una herida, reduce el riesgo de morir desangrado. En un estudio con ratones, se demostró que, cuando la vitamina K es limitada, el cuerpo prioriza la coagulación (supervivencia inmediata) sobre funciones secundarias (salud a largo plazo) como proteger contra la fragilidad ósea tras la pérdida de estrógenos, la prevención de la calcificación arterial (relacionada con enfermedades cardiovasculares) y la protección contra el cáncer.
Con la vitamina D ocurre algo similar. Oficialmente, el corte del déficit se sitúa en 30 ng/mL, y desde la Seguridad Social no se suplementa a menos que los niveles estén por debajo de ese valor. A veces ni tan siquiera en esos casos y cuando se suplementa, no se hace correctamente (tema que ya he tratado en el blog). Sin embargo, en un metaanálisis que comparaba la mortalidad por COVID-19 con los niveles de vitamina D, se sugiere que un nivel teórico de mortalidad cero se alcanzaría con niveles de aproximadamente 50 ng/mL de vitamina D3 en sangre. Este valor coincide con otro metaanálisis que recopiló 32 estudios realizados entre 1966 y 2013, y que concluyó que la menor tasa de mortalidad por todas las causas de enfermedad se sitúa con niveles de vitamina D alrededor de los 50 ng/mL.
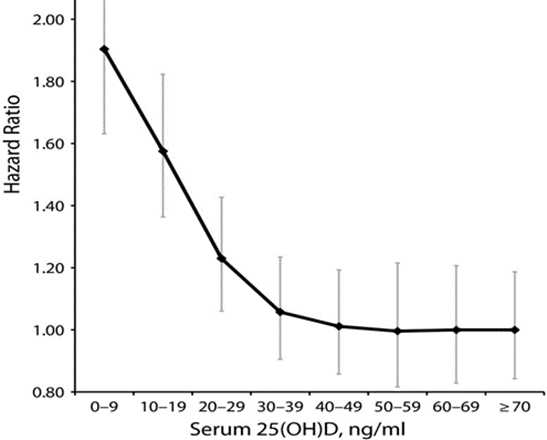
Razones de riesgo generales ajustadas por edad para mortalidad, en 32 estudios de
25-hidroxivitamina D sérica en asociación con mortalidad por todas las causas combinadas: 1966–2013.
¿Ahora ves por qué no es lo mismo no tener un déficit (dentro del rango «oficial») que tener algo en su punto óptimo?
Rangos “óptimos”
Un rango «óptimo» para un biomarcador específico es aquel que permite al organismo realizar todas las funciones dependientes de él, tanto las pocas funciones principales como las muchas funciones secundarias, de manera adecuada. Además, debe estar en un nivel que no sea excesivo ni perjudicial para el cuerpo. Esto es independiente de los valores medios que se encuentran en las personas «sanas» de una población.
En resumen, que no exista un déficit según el rango «oficial» solo significa que las funciones principales, aquellas vitales para la supervivencia inmediata, están cubiertas (y eso, asumiendo que el rango esté bien establecido). Sin embargo, cuando un biomarcador está en su rango «óptimo», además de garantizar la supervivencia, el cuerpo es capaz de realizar funciones secundarias que son cruciales para la salud a medio y largo plazo, lo cual es lo que realmente me interesa para mis clientes y lectores. Después de todo, todos queremos vivir un poco más, pero sobre todo, queremos vivir mucho mejor, ¿no?
Es importante destacar que corregir un déficit o llevar un biomarcador a su rango óptimo es casi imposible solo con la alimentación. Algunos idealistas dirán que, con una dieta perfectamente equilibrada, se puede mantener todo en su rango óptimo y que la suplementación es innecesaria y solo un negocio. Estoy de acuerdo en que la suplementación es un negocio y que hay mucho marketing, además de una falta de regulación que afecta la pureza de muchas marcas. Sin embargo, no coincido en que la suplementación sea evitable si lo que buscamos es alcanzar nuestro máximo potencial.
En primer lugar, nadie, repito, nadie lleva una alimentación perfectamente equilibrada. Y en segundo lugar, nadie, repito, nadie nace con una genética perfecta. Todos tenemos algún polimorfismo genético que afecta la asimilación y el metabolismo de ciertos nutrientes. La teoría es muy bonita, pero cualquiera con experiencia en la práctica clínica sabe que todas las personas tienen algo que puede mejorar con la suplementación adecuada.
Cómo podemos saber los rangos “óptimos”. Relación entre biomarcador y mortalidad.
Para determinar en qué rango debería estar cada biomarcador, prefiero basarme en los estudios que analizan la relación entre el nivel de un biomarcador y la mortalidad por todas las causas. Estos estudios investigan qué niveles altos o bajos de un biomarcador se asocian con un mayor riesgo de muerte por cualquier causa, y establecen un rango óptimo en el que existe la menor probabilidad de muerte.
Estos rangos son generalmente mucho más estrechos que los oficiales y, en muchos casos, bastante diferentes, como vimos con la vitamina D. Veamos otros dos casos relacionados con el riesgo cardiovascular, que suelen sorprender a mis clientes porque lo que les digo no coincide con lo que ven en sus analíticas o con lo que les dice su médico.
Caso 1. El colesterol
No me voy a extender en explicar qué es el colesterol, sus funciones beneficiosas, o por qué no debemos buscar tenerlo lo más bajo posible, ni insistir en que no hay «tipos malos» de colesterol (todos son buenos y necesarios). Ya traté todo esto en un artículo anterior. Aquí, quiero comparar los rangos oficiales que aparecen en las hojas de las analíticas con los rangos que indican los estudios científicos sobre la mortalidad por todas las causas.
Colesterol total:
- Rango oficial: Por debajo de 200 mg/dL.
- Rango óptimo: 200-240 mg/dL (estudio, estudio, estudio). A medida que envejecemos (más de 50 años), la menor mortalidad se observa con niveles aún un poco más altos.
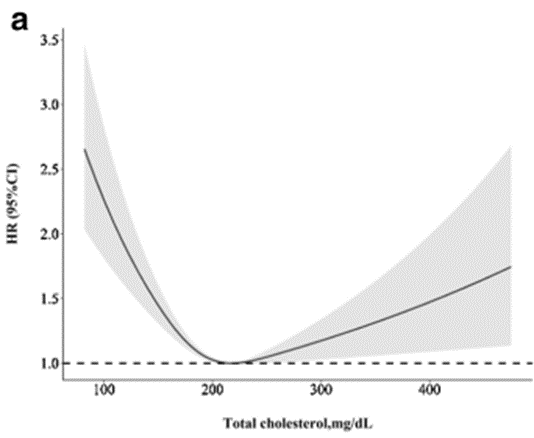
Análisis de splines de mortalidad por todas las causas según los niveles de colesterol total. (Ajustado por edad, sexo, raza, nivel de educación, casado, tabaquismo, índice de masa corporal, presión arterial sistólica, tasa de filtración glomerular estimada, colesterol de lipoproteínas de alta densidad, consumo de energía, hipertensión, diabetes, fármacos antihipertensivos, agentes hipoglucemiantes y fármacos para reducir los lípidos)
Colesterol HDL:
- Rango oficial: Más de 40 mg/dL.
- Rango óptimo: 50-70 mg/dL (estudio, estudio, estudio). En personas mayores de 65 años, la menor mortalidad se asocia con niveles de HDL entre 70 y 80 mg/dL.
Colesterol LDL:
- Rango oficial: Menos de 116 mg/dL para personas con bajo riesgo cardiovascular, con umbrales más bajos para quienes tienen mayor riesgo.
- Rango óptimo: 110-150 mg/dL (estudio, estudio). En hombres mayores de 65 años, el punto óptimo está cerca de 150 mg/dL, y en mujeres, alrededor de 190 mg/dL.
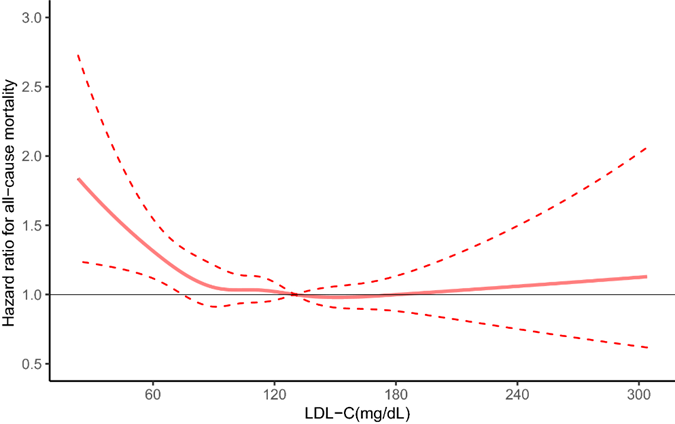
Como puedes ver, el colesterol no es el villano que se ha pintado. De hecho, es más protector a medida que envejecemos. Sin embargo, se sigue insistiendo en reducirlo cada vez más, bajando los rangos oficiales y prescribiendo fármacos para mantenerlo por debajo de esos niveles.
Intentar mantener el colesterol lo más bajo posible para reducir el riesgo cardiovascular es como prohibir la circulación de coches por las carreteras para evitar accidentes de tráfico. Que algo, en este caso el colesterol, sea una causa necesaria para un proceso patológico (como la formación de placa en las arterias) no significa que sea una causa suficiente, ni mucho menos la causa raíz de la enfermedad. Si quitamos los coches de las carreteras, es cierto que no habrá accidentes de tráfico, pero los coches en sí mismos, si están en buen estado, no son los que causan los accidentes, y además, los necesitamos.
La pregunta crucial es: ¿qué hace que el colesterol se adhiera a las arterias y forme placas que obstruyen los vasos sanguíneos, aumentando el riesgo cardiovascular? El colesterol es bueno, lo necesitamos, nos protege, pero debe circular en lugar de acumularse en las arterias. Lo que debemos abordar es lo que causa que se pegue, como mantener un endotelio (la capa interna de las venas y arterias) sano, aumentar el tamaño de las partículas de colesterol (cuanto más grandes, menos probable es que se incrusten), y evitar la oxidación del colesterol. ¿Cómo logramos esto? Reduciendo la inflamación, la homocisteína, la glucosa y la insulina, y utilizando suplementación específica de vitaminas y otros nutrientes, además de adoptar hábitos saludables como una alimentación adecuada, ejercicio regular, y no fumar.
Sin embargo, entiendo que para muchos es más fácil (y conveniente) recurrir a un fármaco que simplemente reduzca el colesterol. No quiero que se me malinterprete: no estoy en contra de las estatinas, creo que son útiles y tienen su lugar en determinadas circunstancias, como en personas que, por genética o por falta de hábitos saludables, no logran mantener su colesterol en rangos adecuados y tienen un contexto que favorece que el colesterol se convierta en un problema en lugar de una protección. Mi crítica es que se abusa de su prescripción, administrando estos fármacos a personas sanas y manteniendo sus niveles de colesterol por debajo de los rangos óptimos, lo que considero contraproducente.
Me cansa ver cómo personas que se cuidan, que comen bien, son activas y tienen un contexto endógeno saludable (bajos niveles de homocisteína, APOB, triglicéridos, glucosa/insulina, proteína C reactiva…) llegan asustadas porque han visto en su analítica (o su médico les ha dicho) que tienen el colesterol alto, con un total de 220 mg/dL y un LDL de 130 mg/dL.
Caso 2. La homocisteína
Rango oficial: Menor de 15 μmol/L.
Rango óptimo: Menor de 8 μmol/L. (estudio, estudio, estudio).
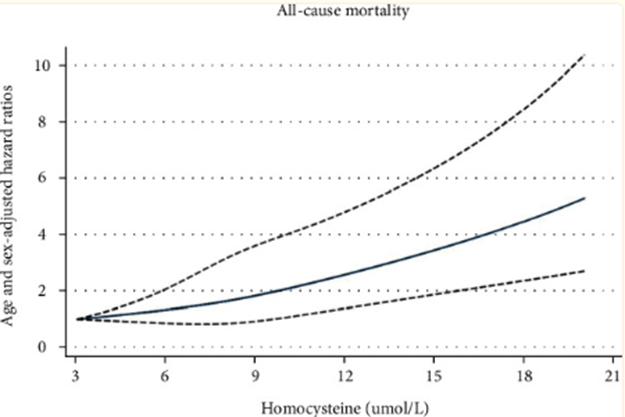
La homocisteína es uno de los biomarcadores «estrella» que debería comprobarse en cada analítica de sangre. Muchísimas páginas de mi libro Epigenética nutricional se las dedico a ella por la importancia que tiene en muy variadas enfermedades. Sin embargo, a menudo no se incluye en los análisis rutinarios, y cuando se mide, muchas veces se interpreta incorrectamente. Por ejemplo, un valor de 14 μmol/L se considera oficialmente «normal», pero para mí, eso es inaceptable.
No voy a profundizar demasiado en este biomarcador aquí, ya que lo abordaré con más detalle en mi próximo libro, pero es fundamental entender que niveles altos de homocisteína afectan muy negativamente a todo el organismo.
Para empezar, la homocisteína daña el revestimiento de los vasos sanguíneos (el endotelio) y promueve procesos inflamatorios y de coagulación. Esto es precisamente lo que hace que el colesterol, que debería circular de forma normal y protegernos, se «pegue» en las paredes de los vasos sanguíneos. Este proceso incrementa el riesgo de desarrollar enfermedades cardiovasculares como arteriosclerosis (endurecimiento de las arterias), trombosis (formación de coágulos), ataques cardíacos y accidentes cerebrovasculares.
Además, la homocisteína elevada aumenta el riesgo de desarrollar Alzheimer. La barrera hematoencefálica, que protege el cerebro de sustancias dañinas en la sangre, está compuesta principalmente por endotelio. Cuando esta barrera se ve afectada por altos niveles de homocisteína, se vuelve más permeable, permitiendo la entrada de neurotoxinas y otras sustancias nocivas en el cerebro, lo que contribuye al desarrollo de enfermedades neurodegenerativas.
Pero la homocisteína no solo afecta al sistema cardiovascular y al cerebro, aunque estas consecuencias por sí solas ya justifican mantenerla por debajo de 8 μmol/L. Como mencioné antes, la homocisteína alta afecta a todo el organismo. Si se acumula y no se convierte en SAMe (S-adenosilmetionina), una molécula crucial para proteger y reparar nuestro ADN, nuestra capacidad para mantener y reparar el organismo se ve comprometida. SAMe también es vital para controlar qué genes se activan o desactivan (un proceso conocido como epigenética). Por lo tanto, con homocisteína alta (y menos SAMe), se reduce nuestra capacidad para proteger el ADN, reparar daños, y manejar la expresión genética de manera óptima, lo que conduce a un envejecimiento acelerado, un peor funcionamiento del organismo y un mayor riesgo de desarrollar diversas enfermedades.
Conclusión:
NO ES LO MISMO QUE ALGO ESTÉ DENTRO DEL RANGO OFICIAL
A QUE ESTÉ EN SU PUNTO ÓPTIMO
He mencionado solo algunos ejemplos, pero esta idea se puede aplicar a casi cualquier biomarcador que aparece en las analíticas de sangre. Además, vale la pena destacar que las analíticas convencionales suelen omitir biomarcadores cruciales para el correcto funcionamiento del organismo, probablemente porque no son mejorables con fármacos. Entre estos están los aminoácidos en suero, la vitamina B6, el selenio, y otros que rara vez se miden, como la homocisteína, el zinc, el magnesio, la insulina, el APOB, y las vitaminas B9, B12, y D.
Particularmente preocupante es el caso de la vitamina D. En las escasas ocasiones en que se mide, su interpretación suele ser incorrecta, y cuando se decide suplementarla, se hace con dosis insuficientes y utilizando formas de la vitamina D menos eficaces para la mayoría de las personas, como ya expliqué en otro artículo.